Es una terapia en desarrollo que se dirige contra una forma mutada de una proteína. Lo probaron en animales y está en marcha un ensayo clínico en Fase I. En qué se diferencia de tratamientos en uso
infobae.com
Los tumores sólidos, como los de mama, pulmón o próstata, cuentan con una forma mutada de una proteína que los ayuda en su expansión. Porque esa proteína contribuye a la replicación y reparación del ADN tumoral.
Un grupo de investigadores de los Estados Unidos, liderados por la científica Linda Malkas, está desarrollando un tratamiento para el cáncer que se dirige específicamente contra esa forma mutada de la proteína. Ya publicaron un estudio con los resultados de los ensayos preclínicos en la revista Cell Chemical Biology.
Hicieron esta comparación: el tratamiento experimental podría funcionar como una “terminal aérea” que tiene múltiples puertas de embarque para tomar aviones. Si la terminal se cierra completamente, se frenan todas las salidas de vuelos. En el caso del potencial fármaco, podría controlar el desarrollo de diferentes tumores sólidos.
 La científica Linda Malkas lidera el desarrollo de la molécula, llamada AOH1996. Es un tratamiento experimental para el cáncer que se dirige específicamente contra una forma mutada de una proteína (City of Hope)
La científica Linda Malkas lidera el desarrollo de la molécula, llamada AOH1996. Es un tratamiento experimental para el cáncer que se dirige específicamente contra una forma mutada de una proteína (City of Hope)Se trata de la proteína llamada “antígeno antígeno nuclear de proliferación celular” (conocida por su sigla en inglés PCNA). Está involucrada en la replicación del ADN celular y es considerada como un índice de proliferación en células tumorales.
“El PCNA es como el centro de una gran terminal aérea que contiene múltiples puertas de embarque. Los datos sugieren que el PCNA se altera de forma única en las células cancerosas, y este hecho nos permitió diseñar un fármaco dirigido únicamente a la forma del PCNA en las células cancerosas”, afirmó la doctora Malkas.
“Nuestra píldora anticancerígena es como una tormenta de nieve que cierra una terminal clave de una aerolínea, cerrando todos los vuelos de entrada y salida sólo en los aviones que transportan células cancerosas”, comparó la investigadora.
El equipo de investigadores probó la intervención en modelos animales con buenos resultados, y tiene en marcha un ensayo clínico de Fase I para probar en humanos la terapia desarrollada.
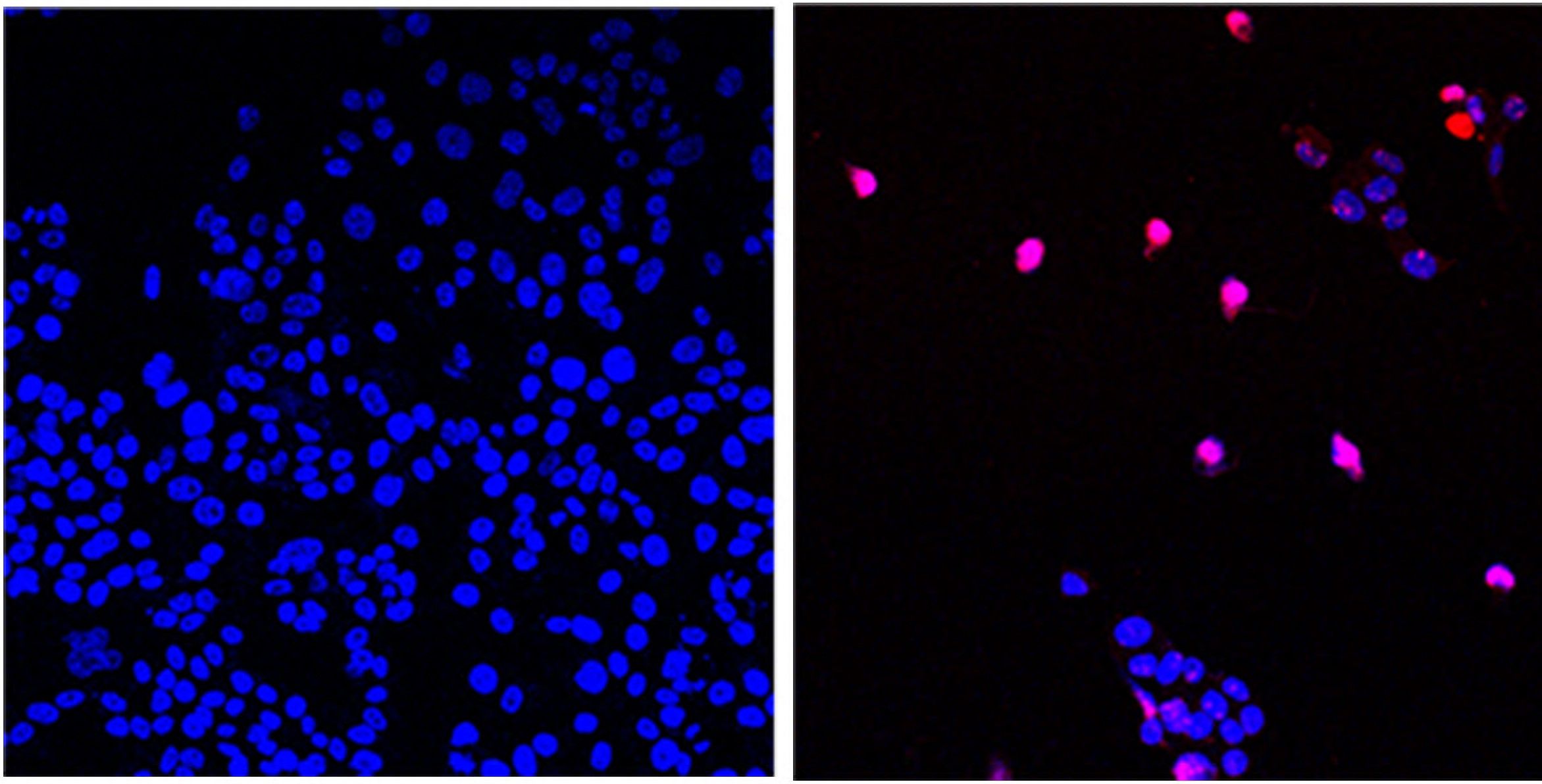 La molécula AOH1996 actúa contra una variante cancerosa de la proteína PCNA. Aquí se ven células cancerosas no tratadas (izquierda) y células cancerosas tratadas con AOH1996 (derecha) sometidas al proceso de muerte celular programada (violeta) (City of Hope)
La molécula AOH1996 actúa contra una variante cancerosa de la proteína PCNA. Aquí se ven células cancerosas no tratadas (izquierda) y células cancerosas tratadas con AOH1996 (derecha) sometidas al proceso de muerte celular programada (violeta) (City of Hope)La mayoría de las terapias dirigidas que ya se usan en pacientes se centran en una única vía. Eso habilita la posibilidad de que el cáncer mute y se haga resistente a la terapia, explicó Malkas, quien es profesora del Departamento de Diagnóstico Molecular y Terapéutica Experimental de la organización City of Hope -un prestigioso centro de tratamiento e investigación para el cáncer y otras enfermedades potencialmente mortales de EEUU- y catedrática M.T. y B.A. Ahmadinia de Oncología Molecular.
En cambio, el fármaco que su grupo ha estado desarrollando durante las dos últimas décadas, que se conoce como “AOH1996″, se dirige solo contra la variante tumoral de la proteína PCNA. Le pusieron ese nombre como un homenaje a una niña que falleció por un cáncer en 2006 y que inspiró la carrera de Malkas. Se llamaba Anna Olivia Healy y había nacido en 1996.
“Los resultados han sido prometedores. AOH1996 puede suprimir el crecimiento tumoral como monoterapia o tratamiento combinado en modelos celulares y animales sin producir toxicidad”, resaltó. Se lo clasifica como una quimioterapia.
 Anna Olivia Healey (1996-2006) fue una niña que tuvo un neuroblastoma, un tipo de cáncer en la cabeza. Su historia motivó a la doctora Malkas, quien llamó AOH1996 al fármaco que está desarrollando. Ese nombre rinde homenaje a la niña (A.N.N.A Fund)
Anna Olivia Healey (1996-2006) fue una niña que tuvo un neuroblastoma, un tipo de cáncer en la cabeza. Su historia motivó a la doctora Malkas, quien llamó AOH1996 al fármaco que está desarrollando. Ese nombre rinde homenaje a la niña (A.N.N.A Fund)El AOH1996 resultó eficaz en investigaciones preclínicas con células derivadas de cáncer de mama, próstata, cerebro, ovario, cuello uterino, piel y pulmón. La organización City of Hope ya concedió la licencia exclusiva a una empresa biotecnológica en la que Malkas es cofundadora y accionista.
Los investigadores probaron AOH1996, una pequeña molécula inhibidora del PCNA, en más de 70 líneas celulares cancerosas y varias células normales de control. Descubrieron que el AOH1996 mata selectivamente las células cancerosas al interrumpir el ciclo reproductivo celular normal.
 Con el desarrollo del tratamiento se busca controlar el avance de los tumores sólidos con menos efectos adversos para los pacientes (National Cancer Institute)
Con el desarrollo del tratamiento se busca controlar el avance de los tumores sólidos con menos efectos adversos para los pacientes (National Cancer Institute)Su objetivo son las colisiones de transcripción-replicación, que se producen cuando chocan los mecanismos responsables de la expresión génica y la duplicación del genoma.
La terapia en investigación impidió que las células con ADN dañado se dividieran en la fase G2/M y realizaran una copia del ADN defectuoso en la fase S. Como resultado, AOH1996 provocó la muerte de las células cancerosas, pero no interrumpió el ciclo reproductivo de las células madre sanas.
“Nadie se había centrado nunca en el PCNA como objetivo terapéutico porque se consideraba ‘imposible de tratar’, pero está claro que City of Hope ha sido capaz de desarrollar un medicamento en investigación para una proteína diana difícil”, comentó el doctor Long Gu, autor principal del estudio y profesor asociado de investigación en el Departamento de Diagnóstico Molecular y Terapéutica Experimental del Instituto de Investigación Beckman de City of Hope.
“Descubrimos que el PCNA es una de las causas potenciales del aumento de los errores de replicación del ácido nucleico en las células cancerosas. Ahora que conocemos el área problemática y podemos inhibirla, profundizaremos en la comprensión del proceso para desarrollar medicamentos contra el cáncer más personalizados y dirigidos”.
 Después de haber realizado estudios preclínicos en animales con la molécula AOH1996, ahora el grupo de Malkas está llevando a cabo un ensayo clínico en fase I con pacientes
Después de haber realizado estudios preclínicos en animales con la molécula AOH1996, ahora el grupo de Malkas está llevando a cabo un ensayo clínico en fase I con pacientesLos experimentos demostraron que la píldora en investigación hacía que las células cancerosas se vuelvan más susceptibles a los agentes químicos que causan daños en el ADN o los cromosomas, como la quimioterapia con cisplatino. Eso sugiere que AOH1996 podría convertirse en una herramienta útil en terapias combinadas, así como para el desarrollo de nuevos quimioterápicos.
En los próximos meses, los investigadores tratarán de comprender mejor el mecanismo de acción para seguir mejorando el ensayo clínico en curso en seres humanos.
La molécula AOH1996 “parece tener un modo de acción único en las células tumorales, que podría hacerla más selectiva”, destacó el doctor Derek Lowe en la revista Science. Al ser más selectiva, el potencial fármaco apuntaría solo a las células cancerosas y no afectaría a las sanas.











